Galvanisk cell - RedOx
Batteri, ackumulator och bränslecell är exempel på galvaniska celler. Ur dom får vi ström.
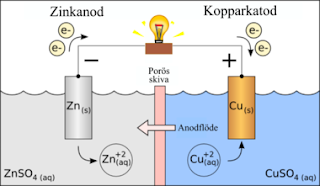
En oädel metall "rostar" (oxiderar) och ger då ifrån sig några av sina elektroner (valenselektronerna). Elektronerna färdas i metaller som t.ex. i sladdar. Batteriet kommer bara att fungera om det finns något som "vill ha" elektronerna. Det kan t.ex. vara en plusladdad metalljon av en metall som är ädlare än den som har oxiderat. När den metalljonen tar upp elektroner så slutar den att vara en jon, och blir ren metall. Att ta upp elektroner kallas för att reduceras.
https://sv.wikipedia.org/wiki/Galvanisk_cell
Oxidationen:
Reduktionen: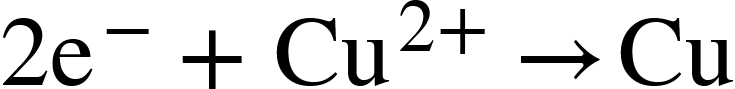
För högre nivå måste man även beskriva varför den "porösa skivan" behövs....
En oädel metall "rostar" (oxiderar) och ger då ifrån sig några av sina elektroner (valenselektronerna). Elektronerna färdas i metaller som t.ex. i sladdar. Batteriet kommer bara att fungera om det finns något som "vill ha" elektronerna. Det kan t.ex. vara en plusladdad metalljon av en metall som är ädlare än den som har oxiderat. När den metalljonen tar upp elektroner så slutar den att vara en jon, och blir ren metall. Att ta upp elektroner kallas för att reduceras.
https://sv.wikipedia.org/wiki/Galvanisk_cell
Oxidationen:
Reduktionen:
För högre nivå måste man även beskriva varför den "porösa skivan" behövs....
Kommentarer
Skicka en kommentar